テクノロジー
アイオープニング
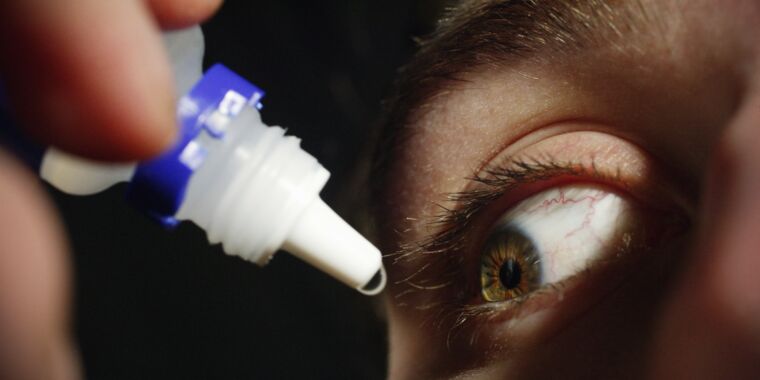
CDCは、EzriCareブランドの人工涙液の使用を中止するよう促しています。
ベス・モーレ –
この記事は詳細な情報が入り次第、更新されます。
広範囲に薬剤耐性を持つ細菌株が米国で初めて拡大し、人工涙液点眼薬に関連した憂慮すべきアウトブレイクを引き起こしていると 注意喚起 は、水曜日の夕方、米国疾病管理予防センターから発表された警告 です。これまでのところ、この細菌は12州の55人にさまざまな感染症を引き起こし、1人が死亡、他の人は入院し、永久的な視力喪失を余儀なくされています。
感染した患者は、合わせて10以上のブランドの人工涙液を使用していると報告し、中には複数のブランドを使用している患者もいました。しかし、患者の中で最もよく使われていたブランドは、WalmartやAmazonなどの小売店で販売されている防腐剤を含まないEzriCare Artificial Tearsであった。
食品医薬品局からリコールは発表されていないが、CDCは、CDCとFDAからの追加ガイダンスを待って、臨床医と患者がEzriCare Artificial Tears製品の使用を中止することを推奨している。EzriCare Artificial Tearsの製造元は、Delsam PharmaのArtificial Tearsとしても販売されている同製品を回収する予定であると発表しています。
テクノロジー 手ごわい敵
発生源となったのは、「藍染」「藍染」「藍染」「藍染」「藍染」の3つの系統。 緑膿菌(Pseudomonas aeruginosaは、環境中、特に淡水中に潜む、極めて汎用性の高い、生来薬剤耐性のある細菌である。様々な皮膚、創傷、火傷、肺、および全身性感染症を引き起こすことが知られています。嚢胞性線維症の患者など、免疫力が低下している人が発症することが多く、特にカテーテルや呼吸器などの医療機器を留置している人の間で大発生することが知られています。病院内では、流し台、製氷機、器具洗浄機、呼吸療法機器、石鹸箱などに潜んでいます。
今回の集団発生では、55人の感染者のうち35人が、医療施設における4つの症例群に関連していました。これら4つの医療関連クラスターの中で、EzriCare人工涙液は施設間で唯一共通の製品でした。また、CDCの調査員は、この集団発生が P. aeruginosa の菌株が、異なるロットで製造され、2つの異なる州の患者から採取されたEzriCare人工涙液ボトルの開封された容器に混入していたことが判明しました。
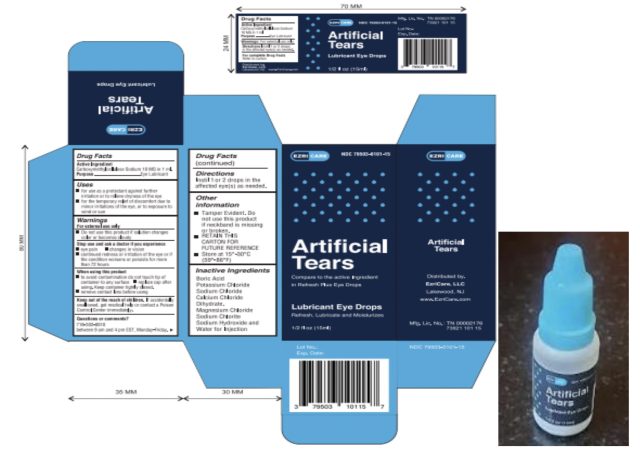
拡大する / エズリケアの製品情報です。
アウトブレイク株は、Verona Integron-mediated Metallo-β-lactamase(VIM)およびGuiana-Extended Spectrum-β-Lactamase(GES)産生カルバペネム耐性という口語的名称を持つ、広範囲に薬剤耐性がある稀な株である。 緑膿菌-またはVIM-GES-CRPAと略される。
多剤耐性ながら 緑膿菌 株は、米国やその他の地域で長い間脅威となっていましたが、VIM-GES-CRPAが米国で広がっていることが確認されたのは、今回が初めてです。この株は、セフェピム、セフタジジム、ピペラシリン-タゾバクタム、アズトレオナム、カルバペネム系抗生物質、セフタジム-アビブクタム、セフトロザン-タゾバクタム、フルオロキノロン、ポリミキシン、アミカチン、ゲンタマイシン、トブラマイシンなどの様々な抗生物質の武器に対して耐性があるとCDCは報告しています。
これまでのところ、3つのアウトブレイク分離株の抗生物質感受性試験は、VIM-GES-CRPA株が、新しい抗生物質であるセフィデロコールにまだ感受性があることを示唆している。 は2019年にFDAの承認を受けました 多剤耐性尿路感染症の治療薬として
2022年5月に始まった今回のアウトブレイクでは、研究者は、喀痰または気管支洗浄13件、角膜スワブ11件、尿サンプル7件、血液サンプル2件、直腸スワブ25件、および他の非滅菌源4件からアウトブレイク株を分離している。患者は、様々な感染症で入院および外来を受診していました。その中には、角膜の感染(角膜炎)、眼球内の組織や液体の感染(眼内炎)などの目の感染症から、呼吸器感染症、尿路感染症、敗血症まで含まれています。死亡した患者さんは全身性の感染症でした。
これまでのところ、症例は12州で発生している。カリフォルニア、コロラド、コネチカット、フロリダ、ニュージャージー、ニューメキシコ、ニューヨーク、ネバダ、テキサス、ユタ、ワシントン、ウィスコンシンの12州である。
テクノロジー レスポンス
において 2月1日の声明で、EzriCare, LLCは次のように述べています。 CDCとFDAの調査に協力していることを発表しました。”今日の時点で、我々は決定的に関連するいかなる検査も認識していない。 緑膿菌(Pseudomonas aeruginosa が発生したことを発表しました。「それにもかかわらず、当社は直ちにEzriCare人工涙液のさらなる流通・販売を停止する措置をとりました。可能な限り、顧客に連絡を取り、同製品の継続的な使用を控えるよう助言しています。”
EzriCareは、人工涙液の製品に限定的にしか関与していないと指摘しています-この製品は他のブランドでも販売されていますが、他のブランドを特定することなく、同社はそう指摘しています。「EzriCare, LLCの役割は、外装ラベルをデザインし、顧客に販売することだけです」と、同社は述べています。この目薬は、インドではGlobal Pharma Healthcare PVT Limitedが製造し、米国にはAru Pharma Inc.が輸入しています。
グローバルファーマヘルスケア 掲載 プレスリリースは、2月1日付で、人工涙液製品を自主的に回収するとのプレスリリースを発表しましたが、FDAによる正式な回収通知は掲載されていません。
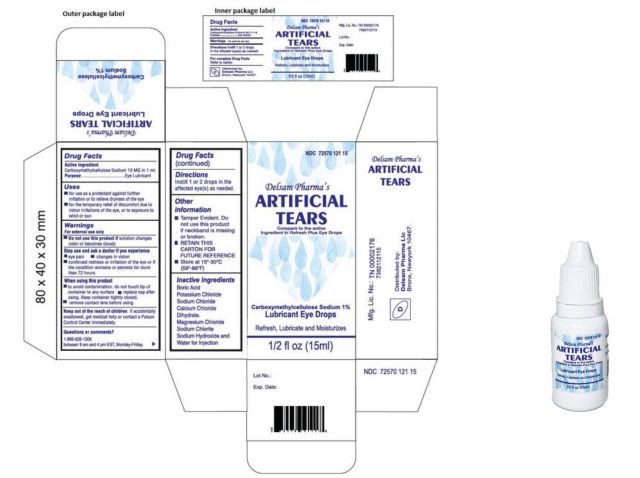
拡大する / デルサム製品情報です。